Agir sur la prise de poids en permutant les génomes mitochondriaux
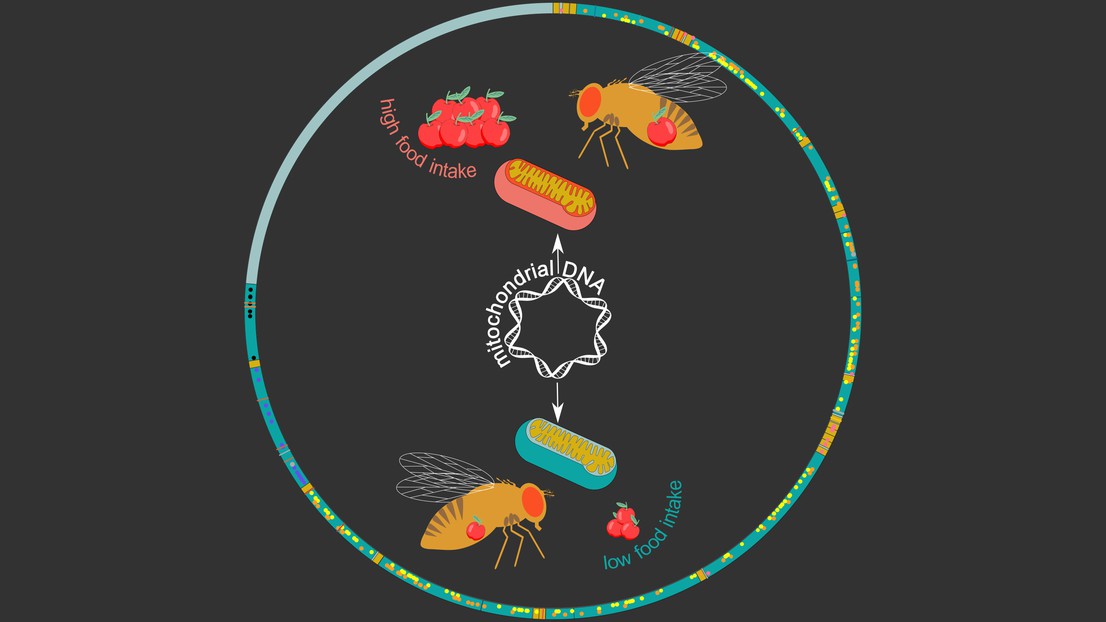
Le génome mitochondrial de la drosophile (cercle). Crédit: Maria Litovchenko/Roel Bevers
Pour découvrir le lien entre la variation génétique et la diversité phénotypique, les généticiens utilisent une série de génomes de drosophiles entièrement séquencés. Toutefois, on sait peu de choses des variations qui ont lieu dans le génome mitochondrial, dont les mutations sont liées à un certain nombre de maladies. Dans ce contexte, des scientifiques de l’EPFL ont créé une carte à haute résolution des variantes d’ADN mitochondrial qu’on trouve chez la drosophile, établissant ainsi un lien entre les gènes mitochondriaux et des caractéristiques et maladies métaboliques.
Image: Le génome mitochondrial de la drosophile (cercle). Les gènes sont représentés en vert foncé, et les points/lignes désignent les variantes génétiques. L’image à l’intérieur montre deux haplotypes mitochondriaux: en vert, celui lié à une faible consommation alimentaire; en rouge, celui lié à une consommation alimentaire élevée. Crédit: Maria Litovchenko/Roel Bevers
De nombreuses caractéristiques qui rendent les gens si distincts les uns des autres découlent souvent de petites différences entre les personnes au niveau de l’ADN. La variation d’une seule base dans notre ADN peut modifier des caractéristiques telles que la durée du sommeil, le poids, la taille, etc. Malheureusement, cela peut aussi s’avérer une source de maladie.
Pour établir un lien fiable entre un gène ou un génome (ce que les biologistes appellent le «génotype») et la variation de caractéristiques (le «phénotype»), les scientifiques ont besoin idéalement d’outils génétiques uniformisés. Le Drosophila Genetic Reference Panel (DGRP), constitué de plus de 200 lignées de la drosophile Drosophila melanogaster, est l’un de ces outils. Le génome de chacune des lignées du DGRP est entièrement séquencé, ce qui permet aux scientifiques de repérer des différences entre des génotypes, puis de les mettre en lien avec des disparités dans les phénotypes qui les intéressent.
La plus grande partie de l’ADN des cellules eucaryotes (les cellules qui constituent les organismes supérieurs tels que les drosophiles et les êtres humains) se trouve dans le noyau cellulaire. Toutefois, la quasi-majorité des cellules eucaryotes possèdent des mitochondries, des organites souvent décrits comme les «centrales énergétiques des cellules». Ce qui les rend uniques, c’est qu’elles renferment leur propre ADN et leur propre génome.
Des études ont suggéré que les variations des gènes mitochondriaux pouvaient être associées à des maladies telles que l’obésité, le diabète de type 2, la sclérose en plaques et la schizophrénie. Le problème, c’est que, contrairement aux gènes «ordinaires» du génome nucléaire, nous ne savons que très peu de choses sur le lien entre la variation des gènes mitochondriaux et la variation phénotypique.
C’est ce sur quoi Roel Bevers et Maria Litovchenko, du laboratoire de Bart Deplancke à l’EPFL, se sont penchés. Leur travail a été publié dans un article paru dans Nature Metabolism. Les chercheurs ont mené une étude approfondie qui a mis en lien les variations de l’ADN mitochondrial et différentes caractéristiques des lignées de drosophiles du DGRP. Leurs résultats peuvent être intégrés à de futures études d’association pangénomique (Genome Wide Association Study, GWAS) pour mieux comprendre comment les variations génétiques – nucléaires et mitochondriales, ainsi que leurs interactions – influencent diverses caractéristiques et maladies.
«Jusqu’à présent, les études effectuées sur la base du DGRP se sont principalement concentrées sur les variantes des gènes nucléaires du fait de la faible couverture de l’ADN mitochondrial, explique Bart Deplancke. Dans notre étude, nous voulions examiner l’impact des variations d’ADN mitochondrial sur les caractéristiques retrouvées chez ces lignées de drosophiles.»
Son équipe a reséquencé les génomes mitochondriaux de 169 lignées de drosophiles du DGRP, puis elle a pu identifier 231 variantes de gènes. Ensuite, elle a examiné les «haplotypes d’ADN mitochondrial», des groupes de variantes toujours héritées ensemble, et a pu identifier 12 haplotypes différents dans les lignées de drosophiles étudiées.
Etonnamment, il s’est avéré que ces haplotypes étaient associés à une série de phénotypes et de maladies métaboliques. «Nous avons trouvé plusieurs liens avec des caractéristiques liées au stress et au métabolisme, y compris la consommation alimentaire chez les mâles», souligne Bart Deplancke. Pour confirmer ce qu’ils avaient trouvé, les chercheurs ont permuté les génomes mitochondriaux entre les lignées de drosophiles, ce qui a entraîné un changement dans le comportement alimentaire des mâles: l’haplotype mitochondrial associé à une consommation alimentaire élevée a provoqué une augmentation de la consommation alimentaire des lignées de drosophiles qui présentaient initialement une consommation alimentaire faible.
Ce travail peut s’avérer utile pour de futures études parce qu’il fournit une meilleure résolution pour mettre en lien des gènes et des caractéristiques, par exemple le comportement alimentaire. «Le DGRP contient une importante variation métabolique mitochondriale spécifique aux haplotypes, concluent les auteurs. Cela démontre l’importance d’intégrer de tels haplotypes aux études portant sur le lien entre le génotype et le phénotype.»
Autres contributeurs
- EPFL (laboratoire de physiologie intégrative et systémique)
- Institut suisse de bioinformatique
- Université de Lausanne (Complex Trait Genetics Group, Robinson Lab)
Initiative suisse en biologie des systèmes (projet AgingX), EPFL
Roel P.J. Bevers & Maria Litovchenko, Adamandia Kapopoulou, Virginie S. Braman, Matthew R. Robinson, Johan Auwerx, Brian Hollis, Bart Deplancke. Mitochondrial haplotypes affect metabolic phenotypes in the Drosophila Genetic Reference Panel. Nature Metabolism, 9 décembre 2019. DOI: 10.1038/s42255-019-0147-3